С жидким состоянием вещества человек встречается на каждом шагу. Прежде всего, это конечно вода, необычная по ряду своих свойств жидкость, так необходимая в повседневной жизни. Это и различные жидкости неорганического и органического происхождения (кислоты, спирты, продукты переработки нефти и т.п.). Наконец, это ртуть – удивительная тяжелая жидкость блестящего цвета, похожая на расплавленный металл. При нагревании до достаточно высоких температур твердые тела расплавляются и переходят в жидкое состояние. Для кристаллических твердых тел такой переход происходит скачком при вполне определенной для данного вещества температуре, называемой температурой плавления. Вместе с тем, существуют так называемые аморфные (стеклообразные) твердые тела, которые по своим свойствам мало отличаются от жидкостей, к их числу относятся стекла, различные смолы, пластмассы. По мере повышения температуры они переходят в жидкое состояние – становятся как бы все более мягкими и приобретают обычную для жидкости способность течь. Их называют иногда переохлажденными жидкостями, поскольку в обычном состоянии такие вещества можно рассматривать как жидкости с аномально большой вязкостью.
При очень низких (по сравнению с комнатной) температурах в жидкое состояние переходит большинство газов. Этот переход также происходит скачком и характеризуется для каждого газа своей определенной температурой перехода – температурой конденсации. Вся так называемая криогенная техника основана на получении и использовании жидкого гелия, жидкого азота и других сжиженных газов.
В отличие от газа, одна из характерных особенностей жидкости заключается в ее способности сохранять свой объем, что проявляется в ее малой сжимаемости. Твердое тело наряду с сохранением объема стремится сохранить также и свою форму. Наиболее важное отличие жидкости от твердого тела заключается в том, что она принимает форму содержащего ее сосуда, образуя при этом свободную поверхность. Это означает, что жидкость обладает высокой текучестью (или малой вязкостью). Газы из-за беспорядочного характера движения их молекул стремятся заполнить весь предоставленный им объем.
Эти свойства жидкости определяются особенностями межмолекулярного взаимодействия в ней. Известно, что в идеальном газе молекулы большую часть времени проводят в состоянии свободного движения, взаимодействуя между собой лишь в редкие моменты их сближения. Среднее расстояние между ними можно определить как r ~ n–1/3, где n – число частиц в единице объема (см. ГАЗ). Для нормальных условий (давление p = 1 атм., температура T = 273 К) это соответствует расстоянию r ~ 3·10–7 см, что в 10 раз больше, чем характерный диаметр самих молекул (d ~ 3·10–8 см). В жидкости молекулы сближены друг с другом, т.е. расстояния между ними оказываются того же порядка величины, что и размеры молекул. Интенсивное взаимодействие между частицами жидкости приводит к тому, что их движение уже нельзя считать полностью неупорядоченным, как в случае газового состояния. Вместе с тем, они не достигают и того полного порядка в расположении молекул, которая характерна для кристаллических твердых тел.
Как известно, особенностью кристаллических твердых тел является периодичность пространственного расположения атомов, молекул или ионов, из которых состоят кристаллы. Совокупность таких периодически расположенных частиц образует структуру, называемую кристаллической решеткой. Подобная периодичность носит название дальнего порядка. Пример двумерного дальнего порядка представлен на рис. 1а.
Экспериментальные исследования жидкого состояния вещества, основанные на наблюдении дифракции рентгеновских лучей и потоков нейтронов при прохождении их через жидкие среды, обнаружили наличие в жидкости ближнего порядка, т.е. наличие некоторой упорядоченности в расположении частиц лишь на малом расстоянии от какой-либо выделенной позиции. Это иллюстрируется картиной, изображенной на рис. 1б.
 Рис. 1. ДАЛЬНИЙ И БЛИЖНИЙ ПОРЯДОК. а – двумерная модель твердого тела, иллюстрирующая наличие дальнего порядка; б – двумерная модель жидкости, иллюстрирующая наличие только ближнего порядка.
Рис. 1. ДАЛЬНИЙ И БЛИЖНИЙ ПОРЯДОК. а – двумерная модель твердого тела, иллюстрирующая наличие дальнего порядка; б – двумерная модель жидкости, иллюстрирующая наличие только ближнего порядка.Распределение частиц в малой окрестности любой фиксированной частицы жидкости имеет определенную упорядоченность, несколько напоминающую кристаллическую, хотя и более рыхлую. По этой причине структуру жидкости иногда называют квазикристаллической или кристаллоподобной.
Впервые идея о близости некоторых свойств жидкостей (особенно расплавов металлов) и кристаллических твердых тел была высказана и затем развивалась в работах советского физика Я.И.Френкеля еще 1930–1940-х. Согласно взглядам Френкеля, получившим теперь всеобщее признание, тепловое движение атомов и молекул в жидкости состоит из нерегулярных колебаний со средней частотой, близкой к частоте колебаний атомов в кристаллических телах. Центр колебаний определяется при этом полем сил соседних частиц и смещается вместе со смещениями этих частиц. Упрощенно можно представить такое тепловое движение как наложение друг на друга сравнительно редких перескоков частиц из одних временных положений равновесия в другие и тепловых колебаний в промежутках между скачками. По образному выражению Я.И.Френкеля, молекулы странствуют по всему объему жидкости, ведя кочевой образ жизни, при котором кратковременные переезды сменяются относительно длинными периодами оседлой жизни. Средняя длительность колебаний в состоянии временного равновесия сильно зависит от температуры, поэтому повышением температуры заметно увеличивается подвижность молекул жидкости и тем самым уменьшается ее вязкость (или возрастает текучесть).
Из-за малой упорядоченности жидкого состояния теория жидкости оказывается менее развитой, чем теория газов и кристаллических твердых тел. Пока нет полной теории жидкости. На уровне существующих теорий ее структура, равно как и физические свойства, могут быть описаны на основе методов статистической механики с использованием различных функций распределения положений групп частиц. При этом в большинстве случаев достаточно знания небольшого числа функций распределения, из которых главное значение имеет так называемая радиальная функция распределения g(r), которая дает вероятность обнаружения какой-либо частицы на расстоянии r от данной, выбранной в качестве точки отсчета. Использование современных ЭВМ позволяет рассчитывать эту функцию методом компьютерного моделирования, основываясь на имеющихся данных о природе сил, действующих между молекулами. Сравнение функций распределения g(r), найденных расчетным путем, с экспериментальными, полученными в результате расшифровки рентгенограмм (или нейтронограмм), позволяет проверить правильность предположений о природе межмолекулярных сил и использовать найденные радиальные функции распределения для определения некоторых свойств жидкостей.
Особый тип жидкостей – это некоторые органические соединения, состоящие из молекул удлиненной или дискообразной формы, или так называемые жидкие кристаллы. Взаимодействие между молекулами в таких жидкостях стремится выстроить длинные оси молекул в определенном порядке. При высоких температурах тепловое движение препятствует этому, и вещество представляет собой обычную жидкость. При температурах ниже критической в жидкости появляется выделенное направление, возникает дальний ориентационный порядок. Сохраняя основные черты жидкости, например, текучесть, жидкие кристаллы обладают характерными свойствами твердых кристаллов – анизотропией магнитных, электрических и оптических свойств. Эти их свойства (наряду с текучестью) находят многочисленные технические применения, например в электронных часах, калькуляторах, мобильных телефонах, а также в мониторах персональных компьютеров, телевизорах, в качестве индикаторов, табло и экранов для отображения цифровой, буквенной и аналоговой информации.
Фазовый переход газ – жидкость. Из опыта известно, что все газы можно перевести в жидкое состояние, если достаточно сильно их сжать или охладить. При нормальных условиях (давление p = 1 атм., температура T = 273 К) газ можно считать идеальным, поскольку среднее расстояние между молекулами газа примерно в 10 раз превышает характерный размер самой молекулы. Если газ сжимать, поддерживая его температуру T постоянной, то пока выполняется условие идеальности газа, уменьшение объема газа V приводит к возрастанию давления p в соответствии с законом Клапейрона – Менделеева, которое для одного моля газа записывается в виде (см. ГАЗ)
(1) pV = RT,
Если повысить давление до 100 атм., то молекулы газа при этих условиях будут в среднем удалены друг от друга на расстояние, которое только вдвое больше их собственных размеров. При дальнейшем повышении давления становится все более существенным учет влияния сил межмолекулярного взаимодействия и собственного объема молекул на поведение газ. Уравнение состояния реального (неидеального) газа уже не подчиняется закону (1). Одним из наиболее часто используемых полуэмпирических уравнений состояния является в этом случае уравнение Ван-дер-Ваальса
(2) 
Поправка b учитывает влияние собственного объема молекул газа, а постоянная a – влияние сил притяжения между молекулами. Хотя уравнение Ван-дер-Ваальса получено для газов не слишком высокой плотности, оно качественно верно описывает поведение достаточно плотных газов и даже переход от газообразного состояния к жидкому.
На рис. 2 представлены типичные экспериментальные зависимости давления от объема для реального газа (при постоянстве температуры) для нескольких значений температур (семейство так называемых изотерм).
Рис. 2.
Ветви изотерм для относительно больших значений объема или малых значений плотности соответствуют газообразному состоянию вещества. В этой области зависимость давления от объема подчиняется уравнению идеального газа (1). Пусть исходное состояние газа на одной из изотерм изображается точкой. При изотермическом сжатии газа точка, изображающая его состояние, будет перемещается вверх по выбранной изотерме. Опыт показывает, что, начиная с некоторой точки A на изотерме, давление в системе перестает повышаться, и процесс дальнейшего сжатия описывается участком горизонтальной прямой AB. Фактически это означает, что, начиная с этой точки, система распадается на две физически однородные части или фазы: газообразную и жидкую. При движении вдоль прямой влево количество жидкости возрастает до тех пор, пока в точке B все вещество не перейдет в жидкое состояние. При дальнейшем уменьшении объема кривая изотермы от точки B резко идет вверх, что соответствует низкой сжимаемости образовавшейся жидкости, при этом более высоким температурам системы соответствуют все более уменьшающиеся горизонтальные участки изотерм. В некоторой точке C этот участок вообще стянется в точку с координатами Tk и pk, которые соответствуют так называемым критической температуре и критическому давлению. При T > Tk у соответствующих изотерм больше нет изломов.
На рис. 2 жирная колоколообразная кривая, соединяющая концы горизонтальных участков изотерм, делит плоскость V – p диаграммы на две области. Область под этой кривой соответствует двухфазному состоянию вещества – равновесие жидкости и ее пара. Область выше кривой соответствует однофазному состоянию вещества, в этой области теряется качественное различие между жидкостью и газом. Фактически это означает, что сжимая газ можно превратить его в жидкость только тогда, когда его температура ниже критической, но это нельзя сделать никаким повышением давления, если температура газа выше критической.
Наличие критической точки ясно показывает, что нет принципиальной разницы между жидким и газообразным состоянием вещества. Можно рассмотреть какие-либо два состояния вещества, соответствующие двум точкам a и b на рис 2. Очевидно, менее плотное состояние (a) отвечает газообразному состоянию, а более плотное (b) – жидкости. Если сжимать газ a при постоянной температуре, то можно превратить его в жидкость b, следуя по одной из изотерм и пройдя при этом стадию расслоения вещества на две фазы, но перейти от одного состояния к другому можно и другим способом, если одновременно с уменьшением объема сначала увеличивать, а затем уменьшать температуру, передвигаясь в плоскости P, V вдоль какого-либо пути, огибающего критическую точку сверху (как это показано пунктиром на рис. 2). При этом вещество везде остается однородным и нельзя сказать, где вещество перестало быть газом и стало жидкостью.
Поведение реальных изотерм, представленных на рис. 2, качественно верно передается уравнением Ван-дер-Ваальса (2). На рис. 3 представлены две такие изотермы, одна из которых имеет точку перегиба, соответствующую критическим значениям Tk и pk, а другая, лежащая ниже, содержит волнообразный участок BDEFA. Такой вид изотермы является графическим изображением уравнения третьей степени относительно величины V, к которому приводится уравнение (2).
Рис. 3
По сравнению с опытной изотермой изотерма Ван-дер-Ваальса вместо горизонтального участка имеет в этой области характерный завиток с максимумом и минимумом. Это означает, что не все состояния вещества, совместимые с волнообразным участком кривой Ван-дер-Ваальса, могут быть реализованы в действительности. В частности, участок DF, где давление растет с увеличением объема, противоречит условию термодинамической устойчивости вещества. Иными словами, при возрастании объема V все изотермы должны монотонно спускаться, что и наблюдается на практике. Вместе с тем при особых условиях могут быть реализованы состояния, изображаемые участками изотермы BD и FA. Эти состояния называются метастабильными.
Испарение и конденсация. Во всей области изменения параметров по ходу прямого участка изотермы Ван-дер-Ваальса существует термодинамическое равновесие межу жидкостью и газом. Это означает, что скорость испарения (число молекул, покидающих единицу поверхности жидкости в 1 с) равна скорости конденсации пара (числу молекул пара, возвращающихся в жидкость). Равновесие с паром, который в таком случае называется насыщенным, устанавливается само собой, если жидкость находится в закрытом сосуде.
Процесс установления такого равновесия можно представить следующим образом. Пар над поверхностью жидкости образуется в результате вылета части молекул с ее поверхности. Для выхода из жидкости испаряющиеся молекулы должны преодолеть силы притяжения со стороны оставшихся молекул, т.е. совершить работу против этих сил. Кроме того, должна быть совершена работа против внешнего давления уже образовавшегося пара. Очевидно, вся эта работа может быть совершена за счет кинетической энергии теплового движения молекул. Естественно, что не все молекулы способны совершить эту работу, а только те из них, которые обладают достаточной для этого кинетической энергией, поэтому переход части молекул в пар приводит к обеднению жидкости быстрыми молекулами, т.е. к ее охлаждению. Ощущение сильного охлаждения кожи, смоченной, например, эфиром (быстро испаряющейся жидкостью) является следствием этого эффекта.
Чтобы скорость испарения жидкости оставалась постоянной и даже возрастала, нужно поддерживать неизменной температуру ее поверхности, что обеспечивается постоянным подводом тепла от внешнего источника. Одновременно с переходом молекул из объема жидкости в газовую фазу происходит и обратный процесс: возвращение части молекул в жидкость (конденсация). Очевидно, число конденсирующихся молекул пропорционально плотности молекул в паре, поэтому в замкнутом сосуде через некоторое время, когда скорости прямого и обратного процессов сравняются, наступает равновесие. Установившаяся таким образом постоянная плотность пара отвечает вполне определенному давлению, которое называется упругостью насыщенного пара, которая растет с повышением температуры.
Переход вещества из одной фазы в другую всегда связан с поглощением или выделением некоторого количества тепла – так называемой скрытой теплоты фазового перехода (или просто теплоты перехода). Количество тепла, необходимое для того, чтобы испарение жидкости с поверхности происходило при постоянной температуре (при внешнем давлении, равном упругости ее насыщенного пара), называется теплотой испарения, которая оказывается универсальной характеристикой каждой жидкости. Обратный испарению процесс конденсации сопровождается выделением тепла. При этом очевидно, теплота конденсации равна теплоте испарения. Теплота перехода является фактически количественной характеристикой сил связи между молекулами вещества – чем больше эти силы, тем больше теплота перехода. Применительно к жидкости можно сказать, что потенциальная энергия молекулы в жидкости меньше ее потенциальной энергии в паре на величину, равную теплоте испарения, отнесенной к одной молекуле. На практике пользуются удельной теплотой испарения (конденсации), которая получается делением молярной (отнесенной к одному молю) теплоты испарения к молекулярной массе жидкости.
Кипение жидкости – процесс ее испарения, сопровождающийся быстрым образованием и ростом пузырьков пара, которые прорываются через поверхность жидкости наружу. Если жидкость в сосуде нагревать при постоянном внешнем давлении, то сначала образование пара носит спокойный характер, поскольку испарение происходит только со свободной поверхности жидкости, однако, при достижении определенной температуры, называемой температурой кипения, образование пара начинает происходить не только со свободной поверхности, но и изнутри жидкости.
В реальности, в самой жидкости или на стенках сосуда, в который она заключена, всегда есть растворенный (или адсорбированный на стенках) воздух или какой-либо другой газ. В этом случае при нагревании жидкости в ней образуются пузырьки воздуха, которые наполняются насыщенным паром окружающей жидкости. В состоянии механического равновесия сумма давлений воздуха и пара внутри пузырька должна равняться внешнему давлению вне пузырька, которое слагается из давления атмосферы и гидростатического давления окружающей жидкости. С повышением температуры жидкости внутреннее давление в пузырьках растет, они начинают увеличиваться в размерах и подниматься вверх под действием архимедовой подъемной силы. Такая двухфазная система (жидкость с воздушными пузырьками) оказывается неустойчивой и начинается бурный процесс кипения.
Температура кипения соответствует условию, при котором давление насыщенного пара равно сумме атмосферного и гидростатического давления на рассматриваемой высоте, откуда следует, в частности, что температура кипения жидкости существенно зависит от внешнего давления. Если поместить сосуд с водой под колпак воздушного насоса, то при откачке воздуха до определенного давления можно заставить воду кипеть при комнатной температуре. С этим же связано наблюдаемое понижение температуры кипения жидкостей при подъеме в горах на большие высоты, где атмосферное давление воздуха заметно ниже давления у подножья. Так, температура кипения воды на высоте 4000 м составляет лишь 85° C по сравнению с температурой кипения 100° C на уровне моря.
Перегретая жидкость и пересыщенный пар. Кипение может происходить лишь в том случае, когда жидкость содержит растворенные в ней газы. При отсутствии газовых пузырьков или центров интенсивного парообразования можно получить перегретую жидкость, т.е. жидкость, температура которой выше температуры кипения при данном внешнем давлении, но которая, однако, не закипает. На изотерме Ван-дер-Ваальса (рис. 3) перегретая жидкость соответствует участку BD, так как давление жидкости на этом участке ниже давления на изотерме-изобаре AB, где оно равно давлению насыщенного пара. Перегретую жидкость можно получить даже тогда, когда в ней есть пузырьки, надо лишь, чтобы они были достаточно малы, так что давление насыщенного пара внутри них оказывается заметно меньшим соответствующего давления пара над плоской поверхностью. При малых размерах пузырька важно и давление на пузырек, связанное с кривизной его поверхности. Сферическая поверхность жидкости, окружающей пузырек, за счет поверхностного натяжения стремится сократиться и возникающее при этом давление добавляется к внешнему давлению, раздавливающему пузырек.
Перегретая жидкость метастабильна, т.е. мало устойчива. При наличии зародышей (например, достаточно крупных пузырьков воздуха) жидкость уже не может существовать как физически однородное тело и часть ее немедленно переходит в пар.
Так же обстоит дело с пересыщенным паром. На изотерме Ван-дер-Ваальса ему соответствует участок FA (рис. 3). Если в пересыщенном паре образовались зародыши новой фазы (например, крупные капельки жидкости), то при определенных условиях, когда равновесное давление пара над поверхностью капельки меньше давления окружающего пересыщенного пара, пар конденсируется. Конденсации пересыщенного пара способствует и наличие пыли или других мелких частиц. Эффективными центрами конденсации оказываются электрически заряженные частицы или ионы. Этот эффект лежит в основе действия одного из основных приборов ядерной физики и физики элементарных частиц – камеры Вильсона.
Камера Вильсона представляет собой герметически замкнутый объем, заполненный каким-либо неконденсирующимся газом (гелий, аргон и пр.) и насыщенными парами некоторых жидкостей (вода, этиловый спирт и пр.). Одна из стенок камеры делается подвижной (в виде поршня или упругой диафрагмы). При адиабатическом расширении температура смеси, заполняющей камеру, понижается. При этом пар становится пересыщенным, но без центров конденсации конденсироваться не будет. Если, однако, через пространство камеры пролетит заряженная частица, она оставит за собой цепочку ионов. На этих ионах, как на зародышах, сразу начинается конденсация пересыщенного пара в виде маленьких капелек, достигающих видимых размеров. Так возникают треки – цепочки капелек, расположенных вдоль траектории ионизующей частицы, которые можно осветить и сфотографировать.
Для наблюдения следов ионизирующих частиц можно использовать и явления в перегретой жидкости, на этом основано действие так называемой пузырьковой камеры, которая появилась гораздо позднее камеры Вильсона. Жидкость в пузырьковой камере (жидкий водород, жидкий гелий, жидкий пропан, фреоны и пр.) находится при температуре, превышающей температуру кипения. От закипания она удерживается высоким давлением над ней. При внезапном понижении давления жидкость оказывается перегретой. Если в этот момент через камеру пролетает ионизующая частица, то в узкой области вдоль ее траектории жидкость вскипает. В результате путь частицы оказывается отмеченным цепочкой пузырьков пара, которую можно зафиксировать.
Затвердевание (кристаллизация) жидкостей – превращение жидкости в твердое тело (затвердевание или кристаллизация) является примером другого фазового перехода. Этот переход происходит при определенной температуре (температуре затвердевания) и сопровождается выделением тепла (теплоты затвердевания). Наоборот, при плавлении твердого тела (переходе его в жидкое состояние) необходима затрата некоторого количества тепла (теплота плавления). Очевидно, теплота плавления должна быть равна теплоте затвердевания.
Как и в случае с перенасыщенным паром, переходящим в жидкость при наличии центров конденсации, возможны состояния, соответствующие переохлажденной жидкости, т.е. жидкости, охлажденной до температуры ниже температуры затвердевания. Такая жидкость обычно очень быстро кристаллизуется при появлении в ней посторонних вкраплений, способных выполнять функции зародышей кристаллической фазы. Существуют, однако, переохлажденные жидкости, в которых скорость кристаллизации очень мала. К ним относятся, например, мед и варенье, которые «засахариваются» лишь по истечении долгого времени. Многие тела, которые в обиходе называют твердыми, не обладают кристаллической структурой, и их правильней рассматривать как переохлажденные жидкости (стекло, асфальт, сапожный вар, некоторые смолы и пр.). В стекле, например, переохлаждение настолько сильное, что практически нет ни образования зародышей, ни кристаллизации на существующих зародышах. Вместе с тем, очень медленный процесс кристаллизации идет и здесь. Он приводит к тому, что по истечении десятков лет стекло может стать мутным («расстекловывание» стекла).
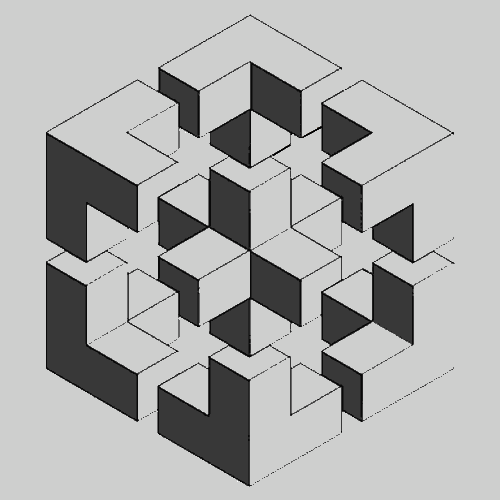
Обычно при расплавлении твердого тела объем его увеличивается примерно на 10%, т.е. среднее расстояние между соседними частицами (молекулами или ионами) в твердом и жидком состояниях почти одинаково. Соответственно при затвердевании жидкостей их объем несколько уменьшается, хотя есть и исключения из этого правила. Например, вода, галлий и висмут при затвердевании расширяются, так что затвердевшее вещество плавает на поверхности жидкости. Вблизи температуры затвердевания возможны и другие аномалии в поведении жидкостей. Так, обычная вода при повышении температуры от 0 до 4° C сжимается. Рентгеноструктурные исследования типичных твердых тел кристаллической структуры показывают, что при переходе их в жидкое состояние дальний порядок нарушается, но какой-то ближний порядок остается. Алюминий, например, кристаллизуется с образованием гранецентрированной кубической решетки (рис. 4), в которой каждый атом окружен двенадцатью ближайшими соседями, расположенными на расстоянии 2,86 А (2,86·10–8 см). В жидком алюминии каждый атом окружен 10–11 ближайшими соседями, расположенными на расстоянии 2,96 А от него. Структура таких жидкостей вблизи температуры затвердевания сходна со структурой кристаллического твердого тела, однако, оказывается несколько более «рыхлой». Оказывается, что для воды, галлия и висмута наблюдается обратная картина: более «рыхлой» вблизи температуры затвердевания является их структура не в жидком, а в твердом состоянии. Причину таких аномалий следует искать в особенностях строения молекул различных веществ и связей между ними в различных агрегатных состояниях.
 Рис. 4. ГРАНЕЦЕНТРИРОВАННАЯ КУБИЧЕСКАЯ СТРУКТУРА кристаллов алюминия
Рис. 4. ГРАНЕЦЕНТРИРОВАННАЯ КУБИЧЕСКАЯ СТРУКТУРА кристаллов алюминияПоверхностное натяжение. Некоторые свойства жидкостей связаны с наличием у них свободной поверхности. Здесь, так же, как и в случае объемных явлений в жидкости, проявляется действие сил межмолекулярного взаимодействия. Природа эффекта поверхностного натяжения. станет яснее из рассмотрения рис. 5. Здесь A и B – две молекулы жидкости, одна в объеме, другая на поверхности. В обоих случаях на них действуют силы притяжения со стороны других молекул, но лишь тех, которые находятся внутри сферы диаметром в несколько ангстрем, поскольку эти силы быстро убывают с расстоянием. Для молекулы A такая сфера полностью лежит внутри жидкости, поэтому равнодействующая всех сил равна нулю. Молекула B, находящаяся на поверхности, будет втягиваться внутрь жидкости, поскольку на нее действуют только силы притяжения со стороны молекул, находящихся в нижней полусфере. Такие же силы, перпендикулярные поверхности и направленные внутрь жидкости, действуют на все молекулы вблизи поверхности; они и создают поверхностное натяжение.
 Рис. 5. СИЛЫ, ДЕЙСТВУЮЩИЕ НА МОЛЕКУЛУ в объеме жидкости (A) и вблизи ее поверхности (В).
Рис. 5. СИЛЫ, ДЕЙСТВУЮЩИЕ НА МОЛЕКУЛУ в объеме жидкости (A) и вблизи ее поверхности (В).Поверхностное натяжение S количественно определяется как сила, действующая на единицу длины линии на поверхности жидкости. Пусть есть мыльная пленка, натянутая на вертикальную рамку из двух тонких проволочек TUV и PQ (рис. 6). Проволочка PQ не закреплена и может свободно передвигаться.
Переход молекулы из глубины жидкости в поверхностный слой связан с необходимостью совершения работы против действующих в поверхностном слое сил. Эта работа, совершаемая молекулой за счет запаса ее кинетической энергии, идет на увеличение потенциальной энергии молекулы. Ситуация здесь подобна рассматриваемой в механике, когда тело брошено вверх телом и работа, совершаемая летящим телом против сил земного тяготения, идет на увеличение потенциальной энергии тела. Таким образом, молекулы в поверхностном слое обладают дополнительной потенциальной энергией (поверхностной энергией). Очевидно, поверхностная энергия пропорциональна площади поверхности раздела
U пов. = aS (3)
Коэффициент a называется коэффициентом поверхностного натяжения или просто поверхностным натяжением
Поверхностное натяжение можно количественно определить как силу, действующую на единицу длины линии на поверхности жидкости. Это можно рассмотреть на примере той же прямоугольной проволочной рамки с подвижной перемычкой, затянутой пленкой жидкости (рис. 6). Пленка двойная, состоит из двух простых пленок, между которыми находится жидкость. Из-за наличия поверхностной энергии пленка стремится сократить свою поверхность, перемычка приходит в движение вверх под действием силы, равной 2 al, где l – длина перемычки. Для удержания в равновесии перемычки к ней надо приложить определенную силу 2F (с учетом присутствия двух пленок).
Рис. 6
Пусть перемычка переместилась в направлении действия силы F на очень малую величину Dx, при этом над пленкой совершена работа DA = 2FDx = 2alDx. Поскольку площадь пленки при таком перемещении увеличится на Ds = 2alDx, производимая над пленкой работа определяется как DA = aDS. Эта величина соответствует увеличению поверхностной энергии жидкости, и в соответствии с формулой (3) введенный выше коэффициент a действительно есть коэффициент поверхностного натяжения, который можно определить из соотношения
 (4)
(4)
Из механики известно, что, положение равновесия тела или системы тел соответствует минимуму потенциальной энергии системы, поэтому жидкость, предоставленная самой себе, принимает форму с минимальной поверхностью, т.е. форму шара. Такую форму шарообразной капли (независимо от ее размеров) приобретает жидкость в невесомости, что неоднократно наблюдалось во время полетов космических кораблей. В земных условиях жидкость принимает форму, соответствующую минимуму суммарной энергии – энергии в поле земного тяготения и поверхностной энергии. Поскольку первая пропорциональна объему тела, а вторая – поверхности, относительное влияние силы тяжести тем больше, чем больше объем капли, поэтому малые капли воды (и в особенности ртути) оказываются практически шарообразными. Большие капли сплющиваются под действием сил тяготения. В земных условиях можно полностью исключить влияние силы тяжести, погрузив некоторую массу жидкости в сосуд с другой жидкостью, которая не смешивается с первой. Плотности обеих жидкостей должны быть при этом одинаковы. Такой опыт был впервые поставлен Плато, который взял смесь спирта и воды и поместил в нее большую каплю оливкового масла. Плотности жидкостей были подобраны одинаковыми, и оливковое масло приняло форму шара.
Проявлением сил поверхностного натяжения является и динамика отрыва капель при ее стекании с какой-либо поверхности (или вытекающих из узкой трубки) под действием сил тяготения. Висящая капля напоминает жидкость, подвешенную в резиновом мешочке. Однако натяжение резиновой пленки меняется с изменением количества заключенной в ней жидкости, а поверхностное натяжение от размеров капли не зависит. Это позволяет объяснить явление отрыва капель. Когда капля достигает определенного размера, на ней образуется шейка (сужение), которая становится все тоньше по мере увеличения размеров капли. В определенный момент на шейке образуется второе сужение, и, наконец, капля разрывается сразу в двух местах. В результате, когда отрывается большая капля, за ней всегда следует малая капелька (шарик Плато).
Капиллярные явления. Своеобразные явления происходят на границе двух несмешивающихся жидкостей, либо жидкости и твердого тела. Форма, которую принимает жидкость в соприкосновении с твердым телом, определяется соотношением трех, действующих на жидкость сил: силы тяжести, сил взаимодействия молекул жидкости и сил взаимодействия между частицами жидкости и частицами твердого тела, с которым она контактирует. Это соответствует разным значениям так называемого краевого угла, т.е. угла, образованного касательной к поверхности жидкости у ее границы с твердым телом и поверхностью самого твердого тела. Так, капля воды на чистой стеклянной пластинке теряет свою сферическую форму и растекается, образуя тонкую пленку, происходит это потому, что силы сцепления между молекулами воды и стекла существенно превышают аналогичные силы между молекулами воды. Краевой угол в этом случае близок к нулю, а явление растекания жидкости носит название полного смачивания. Наоборот, капля ртути на той же пластинке остается сферической, краевой угол в этом случае близок к 180o , что соответствует случаю полного несмачивания.
Если большое количество жидкости налито в широкий сосуд, то форма ее поверхности определяется силой тяжести, которая обеспечивает плоскую горизонтальную поверхность. Однако у самых стенок сосуда поверхность жидкости оказывается искривленной, образуется мениск, вогнутый у смачивающих жидкостей и выпуклый – у несмачивающих. Можно показать, что кривизна поверхности жидкости приводит к появлению дополнительных сил, действующих на жидкость под этой поверхностью. Величина этого дополнительного давления в случае сферической поверхности радиуса  определяется известной формулой Лапласа
определяется известной формулой Лапласа
 (5)
(5)
В случае выпуклой поверхности дополнительное давление направлено внутрь жидкости, т.е. добавляется к нормальному давлению жидкости. В случае вогнутой поверхности жидкость будет находиться под меньшим давлением, чем та же жидкость под плоской поверхностью.
Если жидкость находится в узкой трубке (капилляре), влияние стенок простирается на всю поверхность жидкости и она образует мениск на всем своем протяжении. Очевидно, это имеет место в том случае, когда радиус трубки сравним с радиусом кривизны поверхности жидкости на границе с твердым телом. В таких трубках наблюдаются явления, которые получили название капиллярных явлений. На рис. 7 и 7а изображена узкая трубка, опущенная в широкий сосуд с жидкостью.
 Рис. 7, 7а. СМАЧИВАНИЕ стенок стеклянного капилляра водой проявляется в подъеме жидкости и вогнутости мениска; ртуть не смачивает стенки капилляра и у нее мениск выпуклый и уровень жидкости в капилляре ниже, чем в сосуде.
Рис. 7, 7а. СМАЧИВАНИЕ стенок стеклянного капилляра водой проявляется в подъеме жидкости и вогнутости мениска; ртуть не смачивает стенки капилляра и у нее мениск выпуклый и уровень жидкости в капилляре ниже, чем в сосуде.Пусть стенки трубки смачиваются жидкостью (например, вода и стекло – рис. 7). Тогда вода, проникшая в трубку, образует вогнутый мениск. Вследствие давления, вызванного кривизной поверхности жидкости, вода внутри капилляра испытывает давление p, направленное к центру кривизны мениска, т.е. вверх. Под действием этого давления жидкость поднимается по трубке до уровня h, при котором гидростатическое давление rgh столба воды высотой h, уравновешивает давление p.
Условие равновесия имеет при этом вид
 , (6)
, (6)
где r0 – радиус мениска. Это равенство определяет высоту подъема жидкости в капилляре.
Если краевой угол жидкости, соприкасающейся со стенками капилляра равен q, то
r0 = r/cos q, где r – радиус капилляра. В этом случае высота подъема жидкости в капилляре определяется как
 (7)
(7)
Капиллярным подъемом объясняется ряд широко известных явлений: впитывание жидкости фильтровальной бумагой, движение керосина или масла вдоль фитиля. Капиллярные силы обеспечивают и питание почвенной водой стволов и крон деревьев. Во всех этих случаях волокна соответствующих материалов и древесина играют роль очень тонких капилляров.
Если жидкость не смачивает капилляр, картина будет обратной, так как мениск в этом случае выпуклый и давление Лапласа направлено вниз. Уровень жидкости в капилляре будет теперь ниже ее уровня в сосуде. Простейшим примером служит помещение узкой трубки в сосуд со ртутью (рис. 7а). Формула (7) оказывается по-прежнему справедливой. Значения краевого угла q, лежащие между 90 и 180 градусами, дают отрицательные значения h, что и соответствует уровню, лежащему ниже уровня жидкости в широком сосуде.
Владимир Жданов
Френкель Я.И. Кинетическая теория жидкостей. Л., изд. АН СССР, 1945
Фишер И.З. Статистическая теория жидкостей/ М., Физматгиз, 1961
Крокстон К. Физика жидкого состояния. М., Мир, 1978